17.d-элементы.Железо, общая характеристика, свойства. Оксиды и гидроксиды, КО и ОВ характеристика, биороль, способность к комплексообразованию.
Железо — d-элемент побочной подгруппы восьмой группы четвёртого периода ПСХЭ с атомным номером 26.
Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе.
4Fe + 3O2 + 6H2O = 4Fe(OH)3
В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
3Fe + 2O2 = FeO + Fe2O3
3Fe + 4H2O = FeO*Fe2O3
FeO*Fe2O3 = Fe3O4 (железная окалина)
Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром,марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
1.Физ.св-ва.Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe,кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Очень слабое основание, иногда – амфотерный
Для железа характерны степени окисления железа — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe 3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли кислоты несуществующей в свободном виде кислоты HFeO2):

Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe +2 (Fe +3 O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):

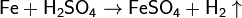
При взаимодействии железа с приблизительно 70%-й серной кислотой при нагревании реакция протекает с образованием сульфата железа(III):
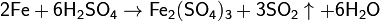
3.Оксиды и гидроксиды, КО и ОВ хар-ка…
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
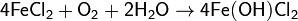
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe 2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe 2+ и [Fe(CN)6] 3− выпадает осадоктурнбулевой сини:
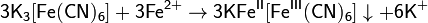
Для количественного определения железа (II) в растворе используют фенантролин , образующий с железом (II) красный комплекс FePhen3 в широком диапазоне рН (4-9)
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами: 
Соли Fe 3+ склонны к образованию кристаллогидратов. В них ион Fe 3+ как правило окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.Ион Fe 3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается [18] в виде Fe(OH)3:
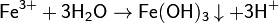
При частичном гидролизе иона Fe 3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.Основные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
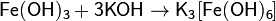
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
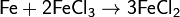
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe 3+ с тиоцианат-ионами SCN − . При взаимодействии ионов Fe 3+ с анионами SCN − образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)] 2+ , [Fe(SCN)2] + , Fe(SCN)3, [Fe(SCN)4]–. Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe 3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe 3+ и [Fe(CN)6] 4− выпадает ярко-синий осадок берлинской лазури:
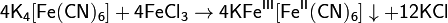
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи [20] , например, феррат(VI) калия K2FeO4. Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде: 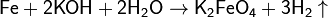
Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода: 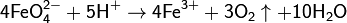
Окислительные свойства ферратов используют для обеззараживания воды.
1)В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания).
2)Обычно железо входит в ферменты в виде комплекса.В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
3)Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз)..
4)Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо – это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar ( Fe ) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:

Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Fe 0 -2 e – → Fe +2 , окисляется восстановитель
Fe 0 -3 e – → Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3

2. Распространённость железа
Железо – один из самых распространенных элементов в природе . В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:


гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:


лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:

пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.

3. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
2) Накалённая железная проволока горит в кислороде, образуя окалину – оксид железа (II,III) – вещество чёрного цвета:
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
4) Железо реагирует с неметаллами при нагревании:
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
На холоде концентрированные азотная и серная кислоты пассивируют железо!
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
8) Качественные реакции на
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: М n , С r , Мо и другие, улучшающие качество стали.
Задания для закрепления
№1. Составьте уравнения реакций получения железа из его оксидов Fe2O3 и Fe3O4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите превращения по схеме:
Fe2O3 -> Fe – +H2O, t -> X – +CO, t -> Y – +HCl -> Z
Назовите продукты X, Y, Z?
Соединения железа:
Железо является самым распространенным металлом в земной коре (5,1% по массе) после алюминия.
На Земле железо в свободном состоянии встречается в незначительных количествах в виде самородков, а также в упавших метеоритах.
Промышленным способом железо добывают на железнорудных месторождениях, из железосодержащих минералов: магнитного, красного, бурого железняка.
Следует сказать, что железо входит в состав многих природных минералов, обуславливая их природную окраску. Окраска минералов зависит зависит от концентрации и соотношения ионов железа Fe 2+ /Fe 3+ , а также от атомов, окружающих эти ионы. Например, присутствие примесей ионов железа влияет на окраску многих драгоценных и полудрагоценных камней: топазов (от бледно-желтого до красного), сапфиров (от голубого до темно-синего), аквамаринов (от светло-голубого до зеленовато-голубого) и проч.
Железо содержится в тканях животных и растений, например, в организме взрослого человека присутствует около 5 г железа. Железо является жизненно важным элементом, оно входит в состав белка гемоглобина, участвуя в транспортировке кислорода от легких к тканям и клеткам. При недостатке железа в организме человека развивается малокровие (железодефицитная анемия).
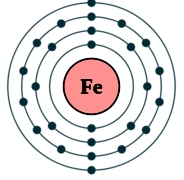
Рис. Строение атома железа.
Электронная конфигурация атома железа – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 6 электронов 3d-подуровня (всего 8 электронов), поэтому в соединениях железо может принимать степени окисления +8, +6, +4, +3, +2, +1, (наиболее часто встречаются +3, +2). Железо обладает средней химической активностью.
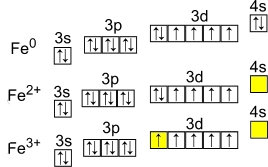
Рис. Степени окисления железа: +2, +3.
Физические свойства железа:
- металл серебристо-белого цвета;
- в чистом виде достаточно мягкий и пластичный;
- хобладает хорошей тепло- и электропроводимостью.
Железо существует в виде четырех модификаций (различаются строением кристаллической решетки): α-железо; β-железо; γ-железо; δ-железо.
Химические свойства железа
- реагирует с кислородом, в зависимости от температуры и концентрации кислорода могут образовываться различные продукты или смесь продуктов окисления железа (FeO, Fe2O3, Fe3O4):
3Fe + 2O2 = Fe3O4; - окисление железа при низких температурах:
4Fe + 3O2 = 2Fe2O3; - реагирует с водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2; - мелко раздробленное железо реагирует при нагревании с серой и хлором (сульфид и хлорид железа):
Fe + S = FeS; 2Fe + 3Cl2 = 2FeCl3; - при высоких температурах реагирует с кремнием, углеродом, фосфором:
3Fe + C = Fe3C; - с другими металлами и с неметаллами железо может образовывать сплавы;
- железо вытесняет менее активные металлы из их солей:
Fe + CuCl2 = FeCl2 + Cu; - с разбавленными кислотами железо выступает в роли восстановителя, образуя соли:
Fe + 2HCl = FeCl2 + H2; - с разбавленной азотной кислотой железо образует различные продукты восстановления кислоты, в зависимости от ее концентрации (N2, N2O, NO2).
Получение и применение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун – это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
- в кислородных конверторах из чугуна;
- восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
- электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).

Рис. Доменная печь.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
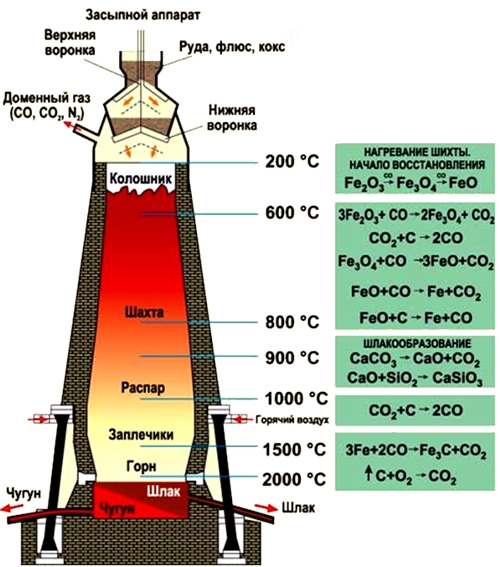
Рис. Процесс выплавки чугуна в доменной печи.
- обогащенные руды (магнитный, красный, бурый железняк) и кокс засыпаются через колошник, расположенный в самом верху доменной печи;
- процессы восстановления железа из руды под действием оксида углерода (II) протекают в средней части доменной печи (шахте) при температуре 450-1100°C (оксиды железа восстанавливаются до металла):
- 450-500°C – 3Fe2O3 + CO = 2Fe3O4 + CO2;
- 600°C – Fe3O4 + CO = 3FeO + CO2;
- 800°C – FeO + CO = Fe + CO2;
- часть двухвалентного оксида железа восстанавливается коксом: FeO + C = Fe + CO.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом.
Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью.
Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой.
Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч.
Чугун и сталь являются важнейшими конструкционными материалами в подавляющем большинстве отраслей народного хозяйства.
Биологическая роль железа:
- в организме взрослого человека содержится около 5 г железа;
- железо играет важную роль в работе кроветворных органов;
- железо входит в состав многих сложных белковых комплексов (гемоглобина, миоглобина, различных ферментов).
Если вам понравился сайт, будем благодарны за его популяризацию  Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
 26-07-2019
26-07-2019 0 Просмотров
0 Просмотров 0 комментариев
0 комментариев 0 Рейтинг
0 Рейтинг