Химический элемент кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Халькогены — родственные кислороду элементы
Сходные по свойствам атомы образуют одну группу в периодической системе. Кислород возглавляет семейство халькогенов, но отличается от них по ряду свойств.
Атомная масса кислорода — родоначальника группы — составляет 16 а. е. м. Халькогены при образовании соединений с водородом и металлами проявляют свою обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода равно –2.
Состав типичных водородных соединений халькогенов отвечает общей формуле: Н2R. При растворении этих веществ образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является и очень слабой кислотой, и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в соединениях с кислородом и другими неметаллами, обладающими высокой электроотрицательностью (ЭО). Состав оксидов халькогенов отражают общие формулы: RO2, RO3. Соответствующие им кислоты имеют состав: H2RO3, H2RO4.
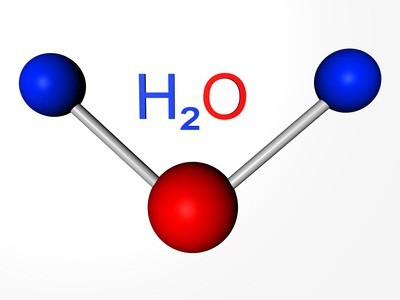
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Формула кислорода — О2. Аллотропное видоизменение того же элемента – озон (О3). Обе модификации являются газами. Сера и селен — твердые неметаллы. Теллур — металлоидное вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет примерно 47 % (по весу). Кислород встречается как в свободном виде, так и в составе многочисленных соединений. Простое вещество, формула которого О2, находится в составе атмосферы, составляя 21 % воздуха (по объему). Молекулярный кислород растворен в воде, находится между частичками почвы.
Мы уже знаем, что есть другая разновидность существования того же самого химического элемента в форме простого вещества. Это озон — газ, образующий на высоте около 30 км от поверхности земли слой, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, органических соединений.
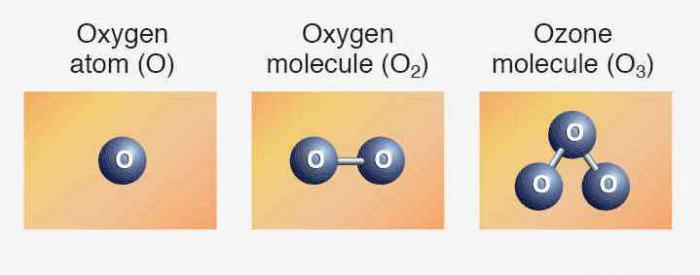
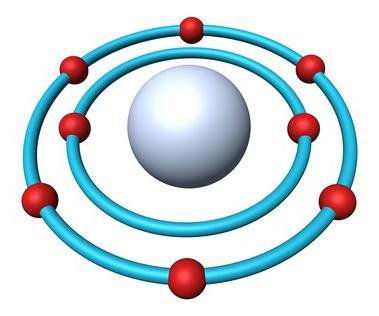
Строение атома кислорода
Периодическая таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Заряд ядра — +8.
- Общее число электронов — 8.
- Электронная формула кислорода — 1s 2 2s 2 2p 4 .
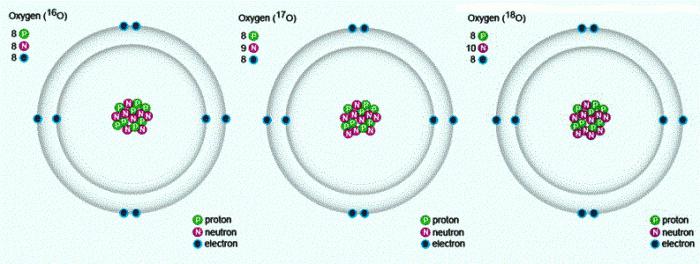
В природе встречаются три стабильных изотопа, которые имеют одинаковый порядковый номер в таблице Менделеева, идентичный состав протонов и электронов, но разное число нейтронов. Обозначаются изотопы одним и тем же символом — О. Для сравнения приведем схему, отражающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
На 2р-подуровне атома имеются два неспаренных электрона, что объясняет появление степеней окисления –2 и +2. Два спаренных электрона не могут разъединиться, чтобы степень окисления возросла до +4, как у серы и других халькогенов. Причина — отсутствие свободного подуровня. Поэтому в соединениях химический элемент кислород не проявляет валентность и степень окисления, равные номеру группы в коротком варианте периодической системы (6). Обычное для него окислительное число равно –2.
Только в соединениях с фтором кислород проявляет нехарактерную для него положительную степень окисления +2. Значение ЭО двух сильных неметаллов отличается: ЭО (О) = 3,5; ЭО (F) = 4. Как более электроотрицательный химический элемент, фтор сильнее удерживает свои электроны и притягивает валентные частицы на внешнем энергетическом уровне атома кислорода. Поэтому в реакции с фтором кислород является восстановителем, отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе опытов выделил газ при разложении оксида ртути. Двумя годами ранее это же вещество в чистом виде получил К. Шееле. Лишь спустя несколько лет французский химик А. Лавуазье установил, что за газ входит в состав воздуха, изучил свойства. Химическая формула кислорода — О2. Отразим в записи состава вещества электроны, участвующие в образовании неполярной ковалентной связи — О::О. Заменим каждую связывающую электронную пару одной чертой: О=О. Такая формула кислорода наглядно показывает, что атомы в молекуле связаны между двумя общими парами электронов.

Выполним несложные расчеты и определим, чему равна относительная молекулярная масса кислорода: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для сравнения: Mr(возд.) = 29. Химическая формула кислорода отличается от формулы озона на один атом кислорода. Значит, Mr(O3) = Ar(O) х 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при обычной температуре и давлении, равном атмосферному). Вещество немного тяжелее воздуха; растворяется в воде, но в небольших количествах. Температура плавления кислорода является отрицательной величиной и составляет –218,3 °C. Точка, в которой жидкий кислород вновь превращается в газообразный, — это его температура кипения. Для молекул О2 значение этой физической величины достигает –182,96 °C. В жидком и твердом состоянии кислород приобретает светло-синюю окраску.
Получение кислорода в лаборатории
При нагревании кислородосодержащих веществ, например перманганата калия, выделяется бесцветный газ, который можно собрать в колбу или пробирку. Если внести в чистый кислород зажженную лучину, то она горит более ярко, чем в воздухе. Два других лабораторных способа получения кислорода – разложение пероксида водорода и хлората калия (бертолетовой соли). Рассмотрим схему прибора, который применяется для термического разложения.
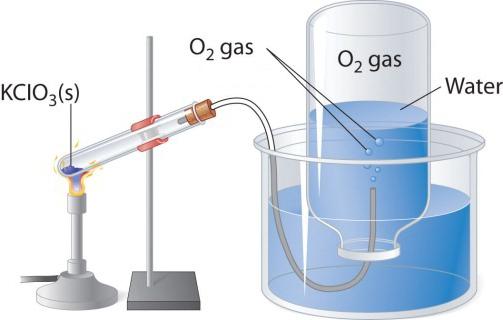
В пробирку или круглодонную колбу надо насыпать немного бертолетовой соли, закрыть пробкой с газоотводной трубочкой. Ее противоположный конец следует направить (под водой) в опрокинутую вверх дном колбу. Горлышко должно быть опущено в широкий стакан или кристаллизатор, наполненный водой. При нагревании пробирки с бертолетовой солью выделяется кислород. По газоотводной трубке он поступает в колбу, вытесняя из нее воду. Когда колба наполнится газом, ее закрывают под водой пробкой и переворачивают. Полученный в этом лабораторном опыте кислород можно использовать для изучения химических свойств простого вещества.
Горение
Если в лаборатории проводится сжигание веществ в кислороде, то нужно знать и соблюдать противопожарные правила. Водород мгновенно сгорает в воздухе, а смешанный с кислородом в соотношении 2:1, он взрывоопасен. Горение веществ в чистом кислороде происходит намного интенсивнее, чем в воздухе. Объясняется это явление составом воздуха. Кислород в атмосфере составляет чуть больше 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются разные продукты, в основном оксиды металлов и неметаллов. Пожароопасны смеси О2 с горючими веществами, кроме того, получившиеся соединения могут быть токсичными.
Горение обычной свечки (или спички) сопровождается образованием диоксида углерода. Следующий опыт можно провести в домашних условиях. Если сжигать вещество под стеклянной банкой или большим стаканом, то горение прекратится, как только израсходуется весь кислород. Азот не поддерживает дыхание и горение. Углекислый газ — продукт окисления — больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие диоксида углерода после горения свечи. Если пропускать продукты горения через гидроксид кальция, то раствор мутнеет. Происходит химическая реакция между известковой водой и углекислым газом, получается нерастворимый карбонат кальция.

Получение кислорода в промышленных масштабах
Самый дешевый процесс, в результате которого получаются свободные от воздуха молекулы О2, не связан с проведением химических реакций. В промышленности, скажем, на металлургических комбинатах, воздух при низкой температуре и высоком давлении сжижают. Такие важнейшие компоненты атмосферы, как азот и кислород, кипят при разных температурах. Разделяют воздушную смесь при постепенном нагревании до обычной температуры. Сначала выделяются молекулы азота, затем кислорода. Способ разделения основан на разных физических свойствах простых веществ. Формула простого вещества кислорода такая же, как была до охлаждения и сжижения воздуха, — О2.
В результате некоторых реакций электролиза тоже выделяется кислород, его собирают над соответствующим электродом. Газ нужен промышленным, строительным предприятиям в больших объемах. Потребности в кислороде постоянно растут, особенно нуждается в нем химическая промышленность. Хранят полученный газ для производственных и медицинских целей в стальных баллонах, снабженных маркировкой. Емкости с кислородом окрашивают в синий или голубой цвет, чтобы отличать от других сжиженных газов — азота, метана, аммиака.

Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Численное значение молярной массы кислорода совпадает с другой величиной — относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Коротко формула вещества кислорода и его молярной массы должна быть записана так: М(О2) = 32 г/моль. При нормальных условиях молю любого газа соответствует объем 22,4 л. Значит, 1 моль О2 — это 22,4 л вещества, 2 моль О2 — 44,8 л. По уравнению реакции между кислородом и водородом можно заметить, что взаимодействуют 2 моля водорода и 1 моль кислорода:
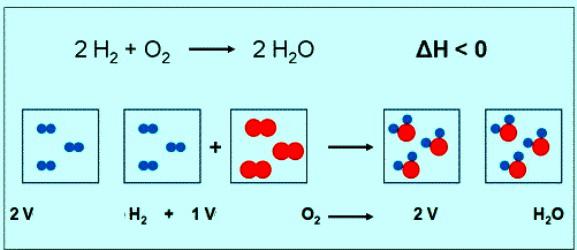
Если в реакции участвует 1 моль водорода, то объем кислорода составит 0,5 моль • 22,4 л/моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ свыше 3 млрд лет. Это главное вещество для дыхания и метаболизма, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород постоянно расходуется на Земле, но его запасы пополняются благодаря фотосинтезу. Русский ученый К. Тимирязев считал, что благодаря именно этому процессу до сих пор существует жизнь на нашей планете.

Велика роль кислорода в природе и хозяйстве:
- поглощается в процессе дыхания живыми организмами;
- участвует в реакциях фотосинтеза в растениях;
- входит в состав органических молекул;
- процессы гниения, брожения, ржавления протекают при участии кислорода, выступающего в качестве окислителя;
- используется для получения ценных продуктов органического синтеза.
Сжиженный кислород в баллонах используют для резки и сварки металлов при высоких температурах. Эти процессы проводят на машиностроительных заводах, на транспортных и строительных предприятиях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве люди тоже нуждаются в молекулах О2. Кислородные подушки применяются в медицине для обогащения состава воздуха, вдыхаемого больными людьми. Газ для медицинских целей отличается от технического практически полным отсутствием посторонних примесей, запаха.

Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, кроме первых представителей семейства благородных газов. Многие вещества непосредственно вступают в реакции с атомами О, исключая галогены, золото и платину. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту, промышленности. В металлургии взаимодействие руд с кислородом называют обжигом. Предварительно измельченную руду смешивают с воздухом, обогащенным кислородом. При высоких температурах происходит восстановление металлов из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Присутствие чистого кислорода повышает скорость технологических процессов в разных отраслях химии, технике и металлургии.
Появление дешевого способа получения кислорода из воздуха методом разделения на компоненты при низкой температуре стимулировало развитие многих направлений промышленного производства. Химики считают молекулы О2 и атомы О идеальными окислительными агентами. Это естественные материалы, они постоянно возобновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода чаще всего завершаются синтезом еще одного натурального и безопасного продукта — воды. Велика роль О2 в обезвреживании токсичных производственных отходов, очистке воды от загрязнений. Кроме кислорода, для обеззараживания используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. При озонировании воды разлагаются загрязняющие вещества. Озон также губительно действует на болезнетворную микрофлору.
Облако меток
Поиск по сайту
Счетчик посещений
Кислород
Кислород был открыт Joseph Priestley в 1777 г. Это газ с критической температурой 119 “С. Он поддерживает горение, но не горит; вырабатывается из воздуха, в готовом продукте доля чистого кислорода составляет 99, 6 %. Только 1 % промышленно получаемого кислорода используется в медицинских целях.
Хранение
В США кислород хранится в баллонах зеленого цвета с давлением в них около 13 600 кПа. В Великобритании он хранится в баллонах черного цвета с белыми плечиками под давлением около 137 бар (13 700 кПа). Кислород может также храниться в виде жидкости в вакуум-изолированном испарителе (ВИИ) под давлением около 10, 5 бар (1050 кПа) при температуре -183 “С. На 1 л жидкого кислорода приходится 840 л газа (баллоны размера Е в заполненном состоянии содержат около 640 л). ВИИ должен находиться в закрытом месте и на расстоянии не менее 6 м от ближайшего рабочего объекта. В этом закрытом месте запрещается курить. Под баллоны должен быть выделен изолированный участок из негорючего материала (не асфальт, так как он горюч). В пределах отгороженного места не должно быть вентиляционных воздухопроводов и канализационных труб. ВИИ расходится на 3 трубопровода, два из которых являются рабочими, а третий соединен с измерительным прибором. Содержимое ВИИ оценивается по убыванию веса.
Кислород можно получать и самостоятельно с помощью концентратора кислорода. Сжатый воздух проходит через зеолит, который утилизирует молекулы азота. Оставшийся газ содержит более 90 % кислорода. Прежде чем повторить процесс прогонки газа через зеолит, его обрабатывают вакуумом, чтобы очистить от азота. Параллельно могут использоваться две зеолитовые камеры для создания постоянного потока кислорода.
Измерение кислорода
1. Концентрация в газовой смеси, а. М а с сспектрометрия. Исследуемый газ бомбардируется струёй электронов, испускаемых нагретым катодом в направлении анода. Некоторые молекулы исследуемого газа, сталкиваясь с электронами, распадаются до ионов. Эти ионы ускоряются в камере до узкого пучка и отклоняются за счет магнитного поля; степень отклонения зависит от их массы: чем они легче, тем больше отклонение. Отклоненные ионы направляются к детектору, который по их количеству определяет количество газа, имеющегося в исследуемой пробе. Масс-спектрометрия — чувствительный метод, позволяющий работать с малыми пробами исследуемого газа.
б. Парамагнитный анализатор. Электроны на внешней орбите кислорода не спарены, поэтому газ обладает парамагнитными свойствами (притягивается магнитным полем). Большинство других газов обладает слабыми диамагнитными свойствами (например, азот). Парамагнитный анализатор представляет собой две заполненные азотом сферы, подвешенные, подобно гантели, на нити в заполненной газом камере. Сферы находятся в магнитном поле. Направление “гантели” изменяется, как только в камеру попадает кислород, перемещающий сферы. Между сферами расположено зеркальце, на которое посылается луч света. По степени отклонения отражаемого от зеркала пучка света оценивается количество кислорода, находящегося в магнитном поле.
Инструмент должен быть откалиброван. Использование закиси азота для заполнения сфер — теоретический источник ошибок, поскольку этот газ уже сам по себе обладает парамагнитными свойствами.
2. Парциальное давление в смеси газов. Ячейка питания состоит из золотой сетки катода и ведущего анода, находящегося в электролитном растворе хлорида калия. С анода испускаются электроны, но только при наличии гидроксилионов, подходящих к аноду. Ячейка питания вырабатывает собственное напряжение, поэтому дополнительных батарей не требуется. Кислород взаимодействует с электронами на катоде, и образуются гидроксилионы. Чем больше в ячейке питания кислорода, тем больше потребляется электронов и тем больше постоянный электрический ток. Эта реакция термочувствительна, поэтому для получения точности результатов необходима температурная стабильность.
3. Напряжение в крови (in vitro). Кислородный электрод (Кларка). В растворе КС1 находятся платиновый катод и анод серебро/хлорид серебpa. Между электродами подается напряжение 0, 6 В; измеряется величина постоянного электрического тока. Ионы серебра и хлора взаимодействуют на аноде, образуя электроны, которые реагируют на наличие 02, подобно описанной выше реакции в ячейке питания. Камера для исследования защищена от контакта с кровью пластиковой мембраной, через которую диффундирует кислород.
Эта реакция термочувствительна. Таким образом, напряжение в крови кислорода оценивается аппаратным способом; затем с учетом показателя рН можно определить сатурацию 02. Возможны ошибки при наличии патологических форм гемоглобина, а также при изменениях концентрации 2, 3-ДФГ.
4. Напряжение в крови (in viuo). Чрескожный электрод. Участок кожи нагревают до 43—44 “С и на это место накладывают кислородный электрод. Кислород диффундирует через кожу из расширенных теплом кровеносных сосудов, при этом измеряется напряжение кислорода в капиллярах.
Возможны погрешности измерений при нарушении метаболизма 02 кожей, а также за счет смещения кривой диссоциации оксигемоглобина при повышении температуры. Неточности появляются и при низком СВ, так как при этом уменьшается перфузия кожи. В этом случае время получения данных возрастает. При нарушении терморегулирующей системы прибора могут возникнуть местные ожоги кожи.
5. Сатурация гемоглобина (in vivo). Пулъсоксиметрия. Свободный и окисленный гемоглобин абсорбируют различное количество света в диапазоне волн от 650 до 950 мм, за исключением волн длиной 803 нм. При пульсоксиметрии используются только две специфические световые волны (около 660 и 940 нм). Диоды, испускающие монохроматичный свет и находящиеся в пальцевом датчике, быстро включаются и выключаются; измерение выполняется фотодиодом при появлении света. Оценивается только тот свет, который постоянно меняется в зависимости от пульсовой волны (т.е. артериальная кровь) в тканях, находящихся между источником света и фотодиодом. Эти данные затем обрабатываются самим аппаратом для расчета уровня сатурации.
Источником возможных ошибок при измерениях могут быть краски и пигментация (лак для ногтей и метиленовый синий), наличие патологических форм гемоглобина (особенно карбоксигемоглобина и метгемоглобина), двигательные артефакты, засветка фотодиода посторонним светом и пульсация венозного ложа (при недостаточности трехстворчатого клапана).
6. Сатурация гемоглобина (in vitro). Ступенчатая оксиметрия. Кровь гемолизируется, и выполняется абсорбционный анализ светом волн различной длины. Таким образом, ступенчатая оксиметрия позволяет провести различие между результатами пульсоксиметрии при различных формах гемоглобина и прежде всего при значительном уровне карбоксигемоглобина, наличие которого хотелось бы исключить.
Токсичность кислорода
Кислород — стабильная молекула с определенным периодом полураспада. При некоторых обстоятельствах последний может снижаться, приводя к образованию токсичных свободных радикалов. К ним относят супероксид и особенно опасный гидроксил. В биологическом плане свободные радикалы кислорода представляют опасность трем “мишеням”: ДНК, липидам и белкам, содержащим серу.
1. Влияние на нервную систему. Симптоматика острой кислородной интоксикации проявляется беспокойством, тошнотой, головокружением, судорожными подергиваниями и даже выраженными судорожными припадками. Последние могут возникнуть вследствие контакта с кислородом при парциальном давлении более 200 кПа. Обычно с этим сталкиваются водолазы.
2. Влияние на легкие. Перекисное окисление липидов — основной механизм кислородной токсичности в отношении легких. При этом поражаются альвеолярнокапиллярные мембраны. Может встретиться абсорбционный коллапс легкого, особенно в зонах с низким соотношением вентиляция/кровоток. Пациенты, у которых нарушена собственная чувствительность к углекислому газу, при появлении гипоксии полагаются на аппаратную вентиляцию. Но даже умеренные концентрации кислорода у этих больных могут привести к дальнейшему угнетению собственного дыхания.
3. Позадихрусталиковая фиброплазия. Гипероксия относится к одному из многих факторов, которые способствуют развитию у новорожденных фиброплазии по задней поверхности хрусталика вследствие нарушений потребления кислорода сетчаткой (это также можно встретить у детей, ранее никогда не получавших поддерживающей кислородной ингаляционной терапии).
Кислород ("рождающий кислоты") открыл в 1774 г. Дж. Пристли. Это самый распространенный химический элемент на Земле – массовая доля кислорода в земной коре составляет 47,2%. В атмосферном воздухе доля кислорода составляет 21%, что связано с деятельностью зеленых растений.
Кислород входит в состав многих, как неорганических, так и органических соединений. Кислород необходим для жизнедеятельности всех высокоорганизованных живых организмов: человека, зверей, птиц, рыб. Кислород составляет от 50 до 85% массы тканей животных и растений.
Известны три стабильных изотопа кислорода: 16 O, 17 O, 18 O.
В свободном состоянии кислород существует в двух аллотропных модификациях: O2 – кислород; O3 – озон.
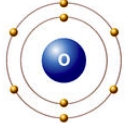
Рис. Строение атома кислорода.
Атом кислорода содержит 8 электронов: 2 электрона находятся на внутренней s-орбитали и еще 6 на внешнем энергетическом уровне – 2 (спаренных) на s-подуровне и 4 (два спаренных и два неспаренных) на p-подуровне (см. Электронная структура атомов).
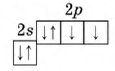
За счет двух неспаренных p-электронов внешнего уровня кислород образует две ковалентные связи, принимая два электрона и проявляя степень окисления -2 (H2O, CaO, H2SO4).
В соединениях с кислородной связью О-О атом кислорода проявляет степень окисления -1 (H2O2).
С более электроотрицательным фтором кислород отдает свои валентные электроны, проявляя степень окисления +2 (OF2).
Двухатомная молекула кислорода образована двойной связью двух атомов кислорода. По этой причине молекулярный кислород при нормальных условиях является устойчивым соединением.
Энергия диссоциации молекулы кислорода примерно в 2 раза ниже, чем в молекуле азота (см. Кратность ковалентной связи), поэтому кислород по сравнению с азотом обладает более высокой реакционной способностью (но, гораздо меньшей по сравнению, например, с фтором).
Реакционная способность кислорода увеличивается по мере нагревания. Кислород реагирует со всеми элементами за исключением инертных газов. По причине своей высокой электроотрицательности (см. Что такое электроотрицательность) в химических соединениях (за исключением фтора) кислород выступает в роли окислителя со степенью -2 (только фтор окисляет кислород с образованием дифторида кислорода OF2).
Свойства газа кислорода:
- газ без цвета, запаха и вкуса;
- в жидком или твердом виде кислород имеет голубую окраску;
- умеренно растворим в воде: массовая доля кислорода при 20°C составляет 0,004%.
Химические свойства кислорода
Во всех реакциях кислород играет роль окислителя, соединяясь со всеми элементами (за исключением гелия, аргона и неона) непосредственным взаимодействием (кроме фтора, хлора, золота и платиновых металлов).
С металлами и неметаллами (простыми веществами) кислород образует оксиды:
При окислении щелочных металлов натрия и калия образуются пероксиды:
Практически все реакции с участием кислорода являются экзотермическими, но есть и исключения:
Многие вещества реагируют с кислородом с большим выделением тепла и света, такой процесс называется горением.
- горение аммиака на воздухе с образованием воды и азота:
- каталитическое окисление аммиака:
- горение сероводорода в избытке кислорода:
- при недостатке кислорода сероводород медленно окисляется до свободной серы:
- горение органических веществ в кислороде с образованием воды и углекислого газа:
- при сгорании азотсодержащих органических веществ кроме углекислого газа и воды выделяется свободный азот:
Многие вещества (спирты, альдегиды, кислоты) получают реакцией контролируемого окисления органических веществ. Также многие природные процессы, например, дыхание или гниение, по своей сути являются окислительными реакциями органических веществ.
Еще более сильным окислителем, чем кислород, является озон, способный окислять йодид калия до свободного йона – эта реакция используется для качественного и количественного определения озона:
Получение и применение кислорода
Кислород находит достаточно широкое применение в промышленности и медицине:
- в металлургии кислород используется при выплавке стали (чугуна);
- в химической промышленности кислород нужен для производства кислот (серной и азотной), метанола, ацетилена, альдегидов;
- в космической промышленности кислород используется в качестве окислителя ракетного топлива;
- в медицине кислород применяют в дыхательных аппаратах;
- в природе кислород играет исключительно важную роль, – в процессе окисления углеводов, жиров и белков происходит высвобождение энергии, необходимой для живых организмов.
Способы получения кислорода:
- промышленные способы:
- сжижением воздуха с последующим разделением жидкой смеси газов на компоненты;
- электролиз воды:
2H2O = 2H2 + O2.
2KMnO4 = K2MnO4 + MnO2 + O2;
2KClO3 = 2KCl + 3O2.
2NaNO3 = 2NaNO2+O2↑
2H2O2 = 2H2O+O2↑;
2CO2+2Na2O2 = 2Na2CO3+O2↑.
Если вам понравился сайт, будем благодарны за его популяризацию  Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
 26-07-2019
26-07-2019 0 Просмотров
0 Просмотров 0 комментариев
0 комментариев 0 Рейтинг
0 Рейтинг