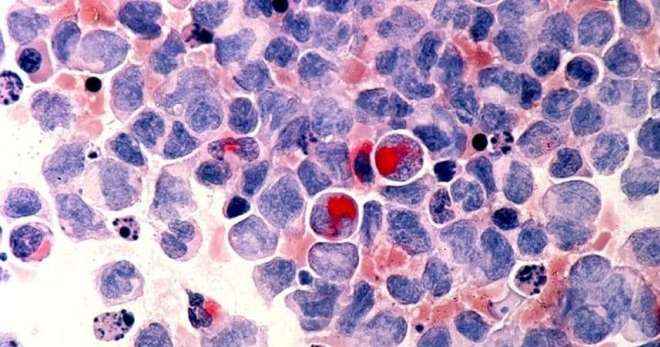
Миелодиспластический синдром – группа патологических состояний, сопровождающихся нарушением процесса кроветворения. Заболевание приводит к изменению основных форменных элементов крови. При отсутствии терапии существует высокий риск развития лейкоза (рака крови).
Миелодиспластический синдром – что это значит?
Миелодиспластический синдром, МДС – болезнь, сопровождающаяся нарушением кроветворения миелоидной ткани. При заболевании происходит нарушение выработки зрелых клеток крови, в результате чего возникает дефицит отдельных видов. Сами клетки крови подвергаются видоизменению, плохо функционируют. Длительное течение болезни приводит к возникновению острого миелоидного лейкоза.
МДС нередко для простоты понимания пациентов специалисты именуют предлейкемией. В медицинской литературе прошлых лет можно встретить термины «дремлющий лейкоз» и «малопроцентный лейкоз», которые хорошо описывают клиническую картину данного нарушения. Подобные определения связаны с уровнем бластных клеток в костном мозге пациента. Превышение уровня в 20 % свидетельствует о наличии миелоидного лейкоза. Если концентрация меньше указанной, выставляют диагноз миелодиспластический синдром.
Миелодиспластический синдром – классификация
В зависимости от характера изменений, повреждаемого типа клеток различают следующие разновидности МДС:
- Миелодиспластический синдром, рефрактерная анемия – длится больше 6 месяцев. При проведении анализа крови фиксируются единичные бласты. В костном мозге обнаруживается дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией – характеризуется наличием единичных бластов, фиксируются панцитопения, рост уровня моноцитов. В костном мозге изменениям подвержено меньше 10 % клеток.
- Миелодиспластический синдром с мультилинейной дисплазией – цитотпения, без увеличения бластных клеток.
- Неклассифицируемый миелодиспластический синдром – характеризуется цитопенией, наличием единичных бластов. Концентрация их не превышает 5 %.
- Миелодиспластический синдром с избытком бластов – цитопения без моноцитоза, без увеличения бластных клеток в периферической крови.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q – форма, обусловленная нарушением генного аппарата. В анализе прослеживаются анемия, тромбоцитоз; концентрация бластов превышает 5 %. При цитогенетическом исследовании обнаруживается изолированная делеция 5q гена.
Причины миелодиспластического синдрома
Зачастую специалистам, диагностировавшим миелодиспластический синдром (МДС), не удается установить конкретную причину возникновения патологии. При этом они всегда стараются выявить первопричину болезни. В зависимости от этого фактора принято выделять две формы миелодиспластического синдрома:
- Идиопатический (первичный) – в большинстве случаев развивается без видимой причины, при отсутствии предпосылок.
- Вторичный – является результатом присутствия других патологий (лимфома, лимфогранулематоз). В отдельных случаях патология может провоцироваться проводимыми накануне лучевой или химиотерапией.
Проводимый онкологами ряд исследований доказал повышенную вероятность развития МДС у людей с генетическими аномалиями:
Первичный миелодиспластический синдром
Диагноз МДС первичной формы составляет 80–90 % всех случаев миелодиспластического синдрома. Этот тип патологии чаще регистрируется у пациентов зрелого возраста, пожилых людей после 60 лет. Однозначно назвать причины развития патологии медикам не удается. Одновременно с этим они выделяют ряд факторов, повышающих риск развития МДС в разы. Среди таковых:
- курение;
- проживание в зонах с повышенным радиоактивным фоном;
- вредные условия труда (постоянный контакт с нефтепродуктами, ядохимикатами);
- врожденные патологии (болезнь Дауна, синдром Фанкони).
Вторичный миелодиспластический синдром
Вторичный МДС встречается в 10–20 % случаев заболевания. Возникает патология в любом возрасте. Частой причиной врачи называют побочный эффект от проводимой химиотерапии и радиоволнового лечения. Кроме того, спровоцировать изменения в картине крови способны некоторые лекарственные препараты:
- Циклофосфамид;
- ингибиторы топоизомеразы (Топотекан, Иринотекан).

Миелодиспластический синдром – симптомы
Симптомы и клиническая картина болезни напрямую зависят от степени нарушения, стадии патологического процесса. В некоторых случаях возможно практически бессимптомное течение. У таких пациентов только во время профилактического осмотра диагностируется миелодиспластический синдром, анемия как один из признаков заболевания крови. При этом пациенты жалуются на наличие неспецифических симптомов патологии:
- слабость;
- утомляемость;
- одышка при малейших нагрузках;
- побледнение кожных покровов;
- головокружения;
- обморочное состояние.
Когда миелодиспластический синдром сопровождается снижением концентрации тромбоцитов в кровяном русле, у пациентов могут фиксироваться периодические носовые кровотечения, обильная кровоточивость десен. Женщины могут отмечать появление меноррагии – обильных месячных. На поверхности кожных покровов появляются кровоподтеки. МДС с выраженным снижением нейтрофилов и агранулоцитозом сопровождается развитием частых простудных болезней, стоматитом. В тяжелых случаях у пациентов развивается пневмония.
Осложнения при миелодиспластическом синдроме
Нарушение работы системы кроветворения отрицательно сказывается на функционировании внутренних систем и органов. Снижение концентрации красных кровяных клеток провоцирует развитие кислородного голодания. В результате таких изменений первыми страдают нервная система и головной мозг. Однако главным из осложнений, которыми сопровождается миелодиспластический синдром, рефрактерная анемия с избытком бластов, является миелоидный лейкоз.
Патология характеризуется разрушением клеток крови, трудно поддается лечению, часто приводит к гибели пациентов. Выходом из ситуации является аллогенная трансплантация костного мозга. Среди других возможных осложнений МДС:
Миелодиспластический синдром – диагностика
Перед тем как выставить диагноз миелодиспластический синдром, анализ крови проводят неоднократно. Развернутое исследование помогает установить, какой непосредственно тип клеток подвергается патологическим изменениям. Эта информация используется для назначения курса терапии в дальнейшем. Комплексное обследование пациента должно включать:
- Исследование костного мозга – морфологическое обследование аспирата, трепанобиопсия с гистологией.
- Генетический тест для выявления возможных хромосомных мутаций (цитогенетический анализ).

Миелодиспластический синдром – лечение
Лечение миелодиспластического синдрома должно осуществляться комплексно. Тактика терапии определяется клинической картиной, симптоматикой, характером лабораторных показателей. При отсутствии признаков анемии, инфекционных патологий специалисты занимают выжидательную тактику. При МДС с выраженной анемией, нейтропенией и тромбоцитопенией, при повышенном риске лейкоза назначают сопроводительную терапию. В тяжелых случаях показана пересадка костного мозга.
При поздних формах болезни, выраженной клинике показан курс химиотерапии. Общепринятых стандартов данного типа лечения не существует. Специалисты активно занимаются разработкой новых лекарственных средств и препаратов. В отдельных случаях для остановки прогресса болезни, облегчения состояния пациента прибегают к иммуносупрессии.
Миелодиспластический синдром – клинические рекомендации
Как лечить миелодиспластический синдром, какие препараты, в какой концентрации использовать – врачи определяют индивидуально.
- Сопроводительное лечение является самой распространенной методикой терапии МДС. Оно предусматривает частые инфузии компонентов крови.
- Длительное применение этой группы препаратов способно спровоцировать повышение концентрации железа в крови. Для исключения такой возможности назначают одновременно прием хелаторов, которые связывают железо и выводят его из организма.
- При терапии МДС с отсутствием хромосомных мутаций используют иммуносупрессоры. Они подавляют иммунитет, способствуют снижению воспалительного процесса.
- Невозможность трансплантации костного мозга является одним из показаний для проведения химиотерапии. Высокие дозировки этих препаратов используют, когда миелодиспластический синдром переходит в лейкоз или имеет место рефрактерная анемия (увеличение концентрации бластов при гиперклеточном костном мозге).
Миелодиспластический синдром – препараты
Лечение МДС включает в себя несколько направлений. В комплексной терапии заболевания зачастую применяется множество лекарственных средств. Среди основных препаратов:
- Иммуносупрессоры – помогают ликвидировать нарушения в иммунной системе, которые проявляются образованием аутоантител, развитием аутореактивных клонов Т-клеток. Представители этой группы: Циклоспорин, иммуноглобулин антитимоцитарный.
- Ингибиторы гиперметилирования – назначаются при МДС высокого риска, с большой концентрацией бластов: Децитабин, Азацитидин.
- Химиотерапия – применяется при повышенном риске перехода в лейкоз: Цитозар.
- Стимуляторы тромбопоэза – применяется при выраженном снижении концентрации тромбоцитов, различных кровотечениях: Ромиплостим, Лонифарниб, Типифарниб.
Миелодиспластический синдром – народные методы лечения
Лечение миелодиспластического синдрома народными средствами не приносит результатов. Заболевание трудно поддается медикаментозной терапии, поэтому врачи утверждают об отсутствии эффекта от использования лекарственных растений. Самостоятельный прием народных средств, отваров, настоек может отрицательно сказаться на состоянии здоровья пациента.
Миелодиспластический синдром – диета
Специальная диета при миелодиспластическом синдроме не предусмотрена. Врачи рекомендуют составлять свое меню, придерживаясь стола №15. Рацион должен обладать калорийностью 3000 ккал, объем жидкости должен составлять 1,5–2 л. Ежедневное меню должно содержать следующие продукты:
- отварные яйца;
- крупы, макаронные изделия;
- овощи и фрукты, зелень;
- пшеничные отруби;
- масло сливочное.
Миелодиспластический синдром – прогноз жизни
Предположительная продолжительность жизни при миелодиспластическом синдроме рассчитывается по разработанной системе WSS. При ее использовании учитывают три основных фактора, за каждый насчитывают 0–3 балла:
- кариотип (плохой, средний, хороший) – 0–2 балла;
- вид заболевания – 0–3 балла;
- необходимость проведения гемотрансфузии: присутствует – 1 балл, нет – 0 баллов.
Полученные показатели суммируются, и определяется группа риска. На основе нее строятся предположения относительно возможной продолжительности жизни:
- 0 баллов – 10–11 лет;
- 1 балл – 5 лет;
- 2 балла – 3–4 года;
- 3-4 балла – 1,5 года;
- 5-6 баллов – 8 месяцев.
Аннотация научной статьи по медицине и здравоохранению, автор научной работы — Мориков Д. Д., Горбачев В. И., Дворниченко В. В.
Статья посвящена современным методам лечения миелотоксического синдрома у онкологических больных после проведенной химиотерапии.
Похожие темы научных работ по медицине и здравоохранению , автор научной работы — Мориков Д.Д., Горбачев В.И., Дворниченко В.В.,
The modern methods of the treatment of myelodepression in polychemotherapy
The article is dedicated to the modern method of the treatment of myelotoxic syndrome in the oncologic patients after chemotherapy.
Текст научной работы на тему «Современные методы лечения миелодепрессии при полихимиотерапии»
measured cytokines are independently predictive for increased mortality in patients with chronic heart failure // J. Am. Coll. Cardiol. – 2000. – Vol.35 (Suppl. A). – P.1183.
42. Rauchhaus M., Koloczek V., Florea V., et al. The relationship between tumor necrosis factor-a and natriuretic peptides in patients with chronic heart failure // Eur. J. Heart Failure. – 1999.
43. Schulz R., Panas D., Catena R., et al. The role of nitric oxide in cardiac depression induced by interleukin-1 beta and tumor necrosis factor alpha // Br.J.Pharmacol. – 1995. – №114.
44. Sgarbi J.A., Maciel R.M. Pathogenesis of autoimmune thyroid diseases // Arq. Bras. Endocrinol. Metabol. – 2009. – Vol. 53. №1. – P.5-14.
45. Shiau M.Y., Huang C.N., Yang T.P., et al. Cytokine promoter polymorphisms in Taiwanese patients with Graves’ disease // Clin. Biochem. – 2007. – Vol.40. №3-4. – P.213-217.
46. Tait K.F., Nithiyananthan R., Heward J.M., Barnett A.H., et al. Polymorphisms of interleukin 4 receptor gene and interleukin 10 gene are not associated with Graves’ disease in the UK // Autoimmunity. – 2004. – Vol.37. №3. – P.189-194.
47. Takeoka K., Watanabe M., Matsuzuka F, et al. Increase of serum interleukin-10 in intractable Graves’ disease // Thyroid. -2004. – Vol.14. №3. – P.201-205.
48. Thomson A.W. and Lotze. M.T. The Cytokine Handbook. London, San Diego: «Academic Press», 2003.
49. Torre-Amione G., Kapadia S., Lee J., et al. Overexpression and functional significance of tumor necrosis factor receptors in human myocardium // Circulation. – 1995. – Vol.92. – P.1487-1493.
50. Torre-Amione G., Kapadia S., Benedict C., et al. Proinflammatory cytokine levels in patients with depressed left ventricular ejection fraction: a report from of SOLVD // J. Am. Coll. Cardiol. – 1996. – Vol.27. – P.1201-1206.
51. Yamada T., Matsumori A., Sasayama S. Therapeutic effects of anti-tumor necrosis factor-alpha antibody on the murine model of viral myocarditis induced encephalomyocarditis virus // Circulation. – 1994. – Vol.94. – P.2930-2937.
52. Zhang J.A., Zhang J., Xu L., et al. Measurement of IL-12 and IL-18 in sera of patients with autoimmune thyroid disease // Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. – 2006. – Vol.22. №5. -P.630-632.
Информация об авторах: 664003 г. Иркутск, ул. Красного Восстания, 1, ИГМУ, кафедра эндокринологии и клинической фармакологии, tanyagoma@mail.ru; Гома Татьяна Владимировна – аспирант; Хамнуева Лариса Юрьевна – заведующая кафедрой, д.м.н.; Орлова Галина Михайловна – заведующая кафедрой, д.м.н., проф.
© МОРИКОВ Д.Д., ГОРБАЧЕВ В.И., ДВОРНИЧЕНКО В.В. – 2010
СОВРЕМЕННЫЕ МЕТОДЫ ЛЕЧЕНИЯ МИЕЛОДЕПРЕССИИ ПРИ ПОЛИХИМИОТЕРАПИИ
Д.Д. Мориков1, В.И. Горбачев2, В.В. Дворниченко1,2 (‘Иркутский областной онкологический диспансер, гл. врач – д.м.н., проф. В.В. Дворниченко; 2Иркутский государственный институт усовершенствования врачей, ректор – д.м.н., проф. В.В. Шпрах, кафедра анестезиологии и реаниматологии, зав. – д.м.н., проф. В.И. Горбачев, кафедра онкологии, зав. – д.м.н.,
проф. В.В. Дворниченко)
Резюме. Статья посвящена современным методам лечения миелотоксического синдрома у онкологических больных после проведенной химиотерапии.
Ключевые слова: миелодепрессия, лейкопения, колониестимулирующий фактор.
THE MODERN METHODS OF THE TREATMENT OF MYELODEPRESSION IN POLYCHEMOTHERAPY
D.D. Morikov1, V.I. Gorbachev2, V.V. Dvornichenko1,2 (‘Irkutsk Regional Oncologic Clinic, 2Irkutsk State Institute for Postgraduate Medical Education)
Summary. The article is dedicated to the modern method of the treatment of myelotoxic syndrome in the oncologic patients after chemotherapy.
Key words: myelodepression, leukopenia, colony-stimulating factor.___________________________
Успехи современной онкологии обусловлены, в первую очередь, внедрением в практику агрессивных программ противоопухолевой терапии. Эти программы, как правило, не обладают достаточной специфичностью, т.е. помимо опухолевых клеток, уничтожают и другие бы-стропролиферирующие ткани, в первую очередь, костный мозг. Депрессии костномозгового кроветворения сегодня стали закономерным явлением для гематологов и онкологов. Как правило, в клинической практике поражения гемопоэза сочетаются с другими патологическими расстройствами [12,16].
Гематологические осложнения противоопухолевой химиотерапии разной степени выраженности встречаются у 88% онкологических больных. Факторы, влияющие на глубину и частоту гемопоэза, обусловлены резервом кроветворения (облучение или химиотерапия в анамнезе, метастазы рака в костный мозг, возраст больного, степень истощения больного), типом химиотерапевтических препаратов, а также дозами, интервалами между курсами, методами введения и особенностями соматического статуса больного. Согласно данным литературы, даже небольшое (до 35%) снижение дозы приводит к значительному ухудшению всех показателей противоопухолевого лечения. Между тем, уже при легких нарушениях
гомеостаза химиотерапевты, как правило, значительно редуцируют дозы химиопрепаратов и увеличивают интервалы между курсами [7].
Одним из неблагоприятных клинических проявлений, представляющих угрозу для жизни больного, является миелотоксичность, которая рассматривается как самостоятельный симптомокомплекс – миелотоксический синдром [9,10,16]. Этот факт подтвержден многими исследованиями, в том числе рандомизированными [22,24]. Миелотоксический синдром (МТС) представляет собой комплекс клинико-гематологических расстройств, проявляющийся снижением количества форменных элементов в периферической крови, в основе которого лежит индуцированное нарушение кроветворения гипопласти-ческого типа. В отличие от других (немиелотоксических) гемоцитопений, при МТС депрессия кроветворения, как правило, сопровождается угнетением роста других бы-стропролиферирующих тканей – эпителия кишечника, мочевыводящих путей и др. [9]. Обычно миелодепрес-сивный эффект возникает на 7-12 день после введения химиопрепаратов, но некоторые из них оказывают отсроченный эффект угнетения гемопоэза в более поздние сроки. Контроль за показателями периферической крови целесообразно продолжать в ряде случаев до 3-6 недель.
Принято считать, что для начала и проведения химиотерапии количество лейкоцитов в периферической крови должно быть не менее 4000 в 1 мкл и тромбоцитов 120х109/л. Поскольку основную защитную роль выполняют нейтрофилы, их число должно быть не менее 15002000 в 1 мкл. По литературным данным при проведении химиотерапии в 90% случаев развивается лейкопения 1-2 степени, а у 30-40% больных – 3-4 степени, требующая поддерживающей терапии на протяжении нескольких недель [9,15,20]. При третьей степени гранулоцитопений увеличивается риск развития инфекционных осложнений. При числе гранулоцитов 0,1х109/л высока опасность развития кандидозов и инфекции. При появлении пи-рогенной реакции возникает фебрильная нейтропения: когда абсолютное число нейтрофилов в лейкоформуле больного менее 1000 в 1 мкл сочетается с повышением температуры тела выше 38,3°С однократно или 38°С двукратно с интервалом в один час. Если нейтропения длится более двух недель, повышается вероятность тяжелых осложнений. Тяжесть состояния определяют грибы и грамотрицательные микробы [15, 16].
Для профилактики и купирования костномозговой недостаточности применяют гемопоэтические факторы роста. Гемопоэтические факторы роста – это большое «семейство» цитокинов, ответственных за регуляцию пролиферации, дифференцировки и функциональные особенности всех ростков гемопоэза, воздействие некоторых из них оценено в клинических испытаниях последнего десятилетия. Многие из этих цитокинов играют важную роль не только в гемопоэзе, но и в других биологических процессах, например, в иммуномодуляции, в острых воспалительных реакциях. В то же время часть из них выполняет функции аутокринных или паракрин-ных факторов роста опухоли. Более того, известны также ингибиторы гемопоэза, которые играют важную роль в патогенезе заболеваний. Некоторые из таких цитокинов апробированы в клинических испытаниях в качестве препаратов, снижающих количество активно делящихся гемопоэтических клеток до введения цикло- и фазоспецифичной химиотерапии [1,21]. Однако, последние не всегда дают желаемый результат, а высокая дороговизна и побочные эффекты данных средств не дают оснований рассматривать их в качестве оптимального пособия.
Наиболее известные из гемопоэтических факторов роста, зарегистрированные для использования при миелосупрессии в клинической практике во всем мире: колониестимулирующие факторы (КСФ) – гранулоци-тарный колониестимулирующий фактор (Г-КСФ) и гра-нуломоноцитарный колониестимулирующий фактор (ГМ-КСФ). Данные факторы являются наиболее эффективными стимуляторами гранулоцитарного ростка кроветворения и позволяют снизить длительность лейкопений и уменьшить число инфекционных осложнений у больных [11,17,18].
При стандартной химиотерапии возможно первичное применение КСФ для профилактики нейтропении, которая определялась после проведенного первого курса химиотерапии. Вторичное использование КСФ подразумевает назначение препарата во время курса химиотерапии, осложнившегося тяжелой миелосупрессией с целью купирования осложнений и избежания необходимости редуцирования доз цитостатических препаратов. И, наконец, Г-КСФ и ГМ-КСФ используют после курса химиотерапии в лечении фебрильной нейтропении для снижения ее продолжительности и осложнений. Однако, строгих рекомендаций для назначения КСФ при проведении стандартной химиотерапии к настоящему времени не разработано из-за отсутствия результатов рандомизированных клинических испытаний [6].
Рекомендацией по использованию онкологами Г-КСФ или ГМ-КСФ могут быть индивидуальные показания для больных с высоким риском миелосупрессии стандартными дозами цитостатиков с целью избежать редукции режима химиотерапии и снижения эффективности.
Для лечения тяжелых форм лейкопении в настоящее
время широко используют получаемые путем генной инженерии лекарственные средства, представляющие собой аналог человеческого гранулоцитарного колониестимулирующего фактора, – препараты молграмостим (син.: лейкомакс), ленограстим, филграстим, пегфлиграстим и др. Эти препараты являются структурными и функциональными аналогами гранулоцитарного колониестимулирующего фактора, стимулирующего рецепторы, расположенные на клеточной мембране плюрипотентных стволовых клеток, к трансформации в мультипотентные клетки – предшественники миелопоэза. Препараты усиливают дифференциацию миелоидных предшественников кровяных клеток и тем самым стимулируют образование гранулоцитов и лимфоцитов. На процесс роста эритроцитов и тромбоцитов эти лекарственные средства существенного влияния не оказывают.
Пегфлиграстим – Г-КСФ пролонгированного действия, что позволяет назначать его однократно, при проведении каждого цикла химиотерапии, потенциально может использоваться у более значительного числа больных, поскольку обладает лучшей переносимостью. Сравнительные рандомизированные клинические исследования у больных раком молочной железы, леченных доксорубицином и доцетакселом, показали, что однократная инъекция Г-КСФ пролонгированного действия
– пегфилграстима (100 мкг/кг или 6 мг фиксированная доза), по меньшей мере, равноэффективна ежедневным инъекциям непролонгированного Г-КСФ – филграстима (5 мкг/кг/день) в уменьшении частоты возникновения, длительности частоты фебрильной нейтропении [2]. В сравнимых клинических условиях без поддержки Г-КСФ этот режим сопровождался фебрильной нейтропенией в 38% случаев. Обращает на себя внимание относительно большое количество побочных реакций, связанных с применением Г-КСФ. По данным Т.Ю. Хричковой (1999, 2005), головная боль отмечена в 30% процентов случаев, боли в костях – в 23%, боль в спине – 17,5%, астения – в 11% и боли в животе отмечалась у 6 человек на 100 случаев применении препарата. Озноб и лихорадка, также является нередким побочным эффектом введения Г-КСФ [2,18]. Еще одной отличительной особенностью колониестимулирующих факторов, ограничивающих их применение, является довольно высокая курсовая стоимость препаратов [23].
Давно известными и широко применяемыми до настоящего времени являются методы лечения лейкопении, основанные на приеме глюкокортикоидов (в средних и высоких дозах) и различных гемостимуляторов [6,19,20]. Известен способ лечения лейкопении после химиотерапии онкологических больных, разработанный М.Л. Гершанович (1982). Способ заключается в том, что с целью гемостимуляции используются глюкокортикоиды, в частности преднизолон в средних дозах 15-25 мг в сутки. Однако, применение кортикостероидов сопровождается лимфопеническим эффектом, оказывает ульцерогенное и гипертензивное действие, вызывает синдром Иценко-Кушинга, гипокалиемию, иммуносупрессию, синдром отмены, что очень осложняет процесс лечения [2].
В связи с наличием побочных эффектов у применяемых в настоящее время препаратов и отсутствие идеального лекарства от лейкопении, учеными активно проводятся изыскания по созданию методики лечения лейкопении.
Так, например, В.А. Горбунова (1995) создала способ лечения лейкопении путем использования колониестимулирующего фактора (ГМ-КСФ) – лейкомакса, который стимулирует рост миелоидных клеток-предшественниц, а также усиливает эффекторную функцию зрелых моноцитов и нейтрофилов с целью стимуляции лейкопоэза [3,4]. Г.В. Муравской с соавт. (1996) разработан способ коррекции лейкопении при химиолучевом лечении онкологических заболеваний путем введения перорально волокнистого угольного сорбента в дозе 30-80 мг/кг массы тела и экстракорпорального облученной в дозе 220 Гр аутокрови внутривенно однократно или многократно [8].
С.Г. Ребиковым и соавт. (1998) создан способ крио-плазмосорбции, по которому дискретным способом проводят плазмаферез с одномоментной экстракцией до 1,5 л плазмы (1,3-1,5 л) с адекватным замещением низкомолекулярными коллоидами и кристаллоидами. Полученную плазму замораживают, после размораживания ядро преципитации утилизируют, плазму сорбируют на гемосорбенте Актилен-1 [11]. При лечении лейкопении у онкологических больных Ю.С. Сидоренко и соавт. (2004) использовали способ иммунотерапии рекомбинантным интерфероном-2Ь в суточной дозе 3х109 ME, который инкубируют в термостате в течение 1 часа при температуре 37°С с 100 мл аутокрови, а затем вводят внутривенно капельно больному в течение 1-1,5 часа, ежедневно, под контролем показателей крови, до достижения содержания лейкоцитов – >4х109/л, гранулоцитов
– >2х109/л. Способ позволяет преодолеть лейкопению,
1. Антонеева И.И. Динамика уровня цитокинов в крови больных раком яичников при прогрессировании опухоли // Вестник РУДН. Серия: Медицина. – 2007. – №6. – С.479-482.
2. Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных опухолей. – М., 1982 – С.32-43.
3. Горбунова В.А. Значение лейкомакса (гранулоцитарно-макрофагальный колониестимулирующий фактор) в онкологии и гематологии // Вопросы онкологии. – 1995. – Т.41. №1. – С.21-28.
4. Горбунова В.А. Использование лейкомакса с целью интенсификации комбинированной химиотерапии мелкоклеточного рака легкого // Вопросы онкологии. – 1995. – Т.41. №1. – С.72-74.
5. Гуревич К.Я., Костюченко А.Л. Концепция клиники экстракорпоральной гемокоррекции // Эфферентная терапия. – 1995. – Т.1. №1. – С.8-13.
6. Дмитриева Н.В., Петухова И.Н. Рациональные подходы к лечению фебрильной нейтропении у онкологических больных. – М.: Боргес, 2003. – С.15-18.
7. Евтушенко Г.В., Свинцицкий В.С. Побочные эффекты химиотерапии и их коррекция у больных с распространенным раком яичника // Украинский химиотерап. журнал. -2000. – Т.8. №4. – С.32-36.
8. Муравская Г.В., Синайко В.В., Морозова А.А., Крутилина Н.И. Патент 2062102 Российская Федерация, МПК7 A61K33/44, A61K35/14, A61N5/10. Способ коррекции лейкопении при химиолучевом лечении онкологических заболеваний; Науч.-исслед. ин-т онкологии и мед. радиологии МЗ Республики Беларусь. – № 5064653/14 ; заявл. 30.06.1992 ; опубл. 20.06.1996, Бюл. №3. – 5 с.
9. Муравьев В.В., Андрюхин В.И., Артеменко А.Г. и др. Миелотоксический синдром: перспективные направления научного поиска // Актуальные вопросы клинической медицины, сохранения здоровья и реабилитации сотрудников специальных войск: материалы науч.-практ. конф. ВМИ ФСБ РФ. – Нижний Новгород, 2005 – С.92-193.
10. Муравьев В.В., Черепанова В.В., Андрюхин В.И. и др. Распространение миелотоксического синдрома среди пациентов гематологических и онкологических стационаров // Нижегородский мед. журн. – 2008. – №6. – С.6-10.
11. Птушкин В.В. Роль гранулоцитарного и гранулоцитарно-макрофагального колониестимулирующих факторов в лечении инфекции при нейтропении // Онкология. – 2001. – Т.3. №3. – С.32-36.
12. Руководство по химиотерапии опухолевых заболеваний / Под ред. Н.И. Переводчиковой. – 2-е изд., доп. – M.: Практическая медицина, 2005. – 365 с.
13. Сидоренко Ю.С. Экстракорпоральное инкубирова-
дозолимитирующую токсичность, снизить количество инфекционных осложнений в случае фебрильной ней-тропении и сроки лечения [13]. Однако, известные способы обладают низкой эффективностью лечения лейкопении, высокой токсичностью, приводят к дополнительным осложнениям и побочным эффектам и высокой курсовой стоимости.
В настоящее время сохраняется существенная потребность в лекарственных средствах, которые могли бы уменьшить токсическое воздействие цитостатиков и радиоактивного облучения на белые кровяные тельца и стволовые мультипотентные клетки костного мозга и замедлить развитие лейкопении. Это существенным образом расширило бы возможности химио- и радиотерапии и в ряде случаев позволило бы достичь полной ремиссии,
и, следовательно, увеличить продолжительность жизни больных [5].
ние цитостатиков в естественных средах организма – новые методы эффективной и щадящей химиотерапии рака // Сибирский онкологический журнал. – 2004. – Т.10-11. № 2-3.
14. Функциональное состояние клеток крови при миело-токсическом синдроме // Клиническая гемореология: материалы междунар. конф. – Ярославль, 2005. – С.236-241.
15. Хричкова Т.Ю. Механизмы развития миелотокси-ческих эффектов в процессе противоопухолевой химиотерапии у больных злокачественными новообразованиями: Автореф. дис. . д-ра мед. наук. – Томск, 2009. – 52 с.
16. Хричкова Т.Ю, Гольдберг В.Е., Матяш М.Г., Симолина Е.И. Механизмы угнетения и восстановления кроветворения у онкологических больных в условиях полихимиотерапии // Проблемы онкофармакологии: материалы науч.- практ. конф. – Томск: изд-во ТГУ, 2008. – С.48-52.
17. Хричкова Т.Ю., Гольдберг Е.Д., Дыгай А.М., Жданов В.В. Влияние Г-КСФ на кинетику гемопоэтических предшественников регенерирующего костного мозга // Клеточные технологии в биологии и медицине. – 2005. – №1. – С.56-59.
18. Хричкова Т.Ю., Гольдберг Е.Д., Дыгай А.М., Жданов
B.В. Влияние рекомбинантного гранулоцитарного колониестимулирующего фактора и пантогематогена на гемопоэз в условиях цитостатической миелосупрессии // Актуальные вопросы экспериментальной морфологии. – Томск, 1999. –
19. Хричкова Т.Ю., Дыгай А.М., Гольдберг Е.Д., Жданов В.В. Новые подходы в создании гемостимуляторов для клинической практики // Человек и лекарство: тез. докл. VII Рос. национ. конгресса. – М., 2000. – С.494.
20. Bodey J.P. Quantitative relationships between circulating leukocytes and infection in patients with acute leukaemia // Ann. Intern.Med. – 1966. – Vol.64. – Р.328-341.
21. Crowford J. Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer // NEJM. – 1991. – Vol.325.
22. Gonzalez-Martin A.J. Randomized phase II trial of carboplatin versus paclitaxel and carboplatin in platinum-sensitive recurrent advanced ovarian carcinoma: A GEICO (Grupo Espanol de Investigacion en Cancer de Ovario) study // Ann Oncol. – 2005. – Vol.16. – Р.749-755.
23. OzolsR.F. New treatment for ovarian cancer // Educational lectures 17 th ICACT. – 2006. – Р.23.
24. Scarfone G. A multicenter, randomized phase III study of paclitaxel/carboplatin (PC) versus topotecan/paclitaxel/ carboplatin (TPC) in patients with stage III (residual tumor > 1 CM-RT) and IV ovarian cancer (OC) // Proc. ASCO. – 2003. -Vol.22. – Р.450 (abs. 1807).
| Миелодиспластический синдром | |
|---|---|
| МКБ-10 | D 46 46. |
| МКБ-9 | 238.7 238.7 |
| МКБ-9-КМ | 238.75 [1] и 238.7 [1] |
| МКБ-О | 9980/0-M9989/3 |
| OMIM | 614286 и 614286 |
| DiseasesDB | 8604 |
| eMedicine | med/2695 ped/1527 ped/1527 |
| MeSH | D009190 |
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. населения в год и увеличивается с возрастом. [2]
Содержание
Типы, факторы риска [ править | править код ]
Первичный (идиопатический) тип — 80-90 % случаев, вторичный (вследствие предшествующей химиотерапии и др. факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и др.), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
Факторы риска, первичный МДС
- Контакт с токсинами (бензин, органические растворители, в частности бензол, пестициды)
- Радиация
- Курение
- Врождённые и наследственные заболевания
- Пожилой возраст
Факторы риска, вторичный МДС
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз
Патогенез [ править | править код ]
Причины МДС до конца не известны. В основе патогенеза МДС лежит воздействие повреждающих факторов на полипотентную стволовую клетку, приводящее к появлению в ней генетических аномалий, а также феномена гиперметилирования ДНК.
Указанные нарушения приводят к нарушению продукции клеток миелоидного ростка и появлению миелобластов в костном мозге и периферической крови, вследствие чего появляются диспластические изменения в зрелых клетках и их функциональная недостаточность, приводящие к описанным клиническим проявлениям.
Феномен гиперклеточности костного мозга на фоне периферической цитопении объясняется ускоренным апоптозом аномально пролиферирующих клеток костного мозга. [5]
Клиническая картина [ править | править код ]
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией. При этом необходимо дифференцировать МДС от железо- или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
В связи с этим диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
План обследования пациентов [ править | править код ]
Для анализа изменений в периферической крови проводится полный, с подсчетом ретикулоцитов (ускоренный эритропоэз с макроцитозом в ответ на гемолиз и острую кровопотерю приводит к увеличению ретикулоцитов), тромбоцитов и лейкоцитов клинический анализ крови. Типичными находками являются изменения формы клеток, патологические включения и уменьшение числа клеток одного или нескольких ростков кроветворения.
Другим ключевым с точки зрения диагностики МДС оценки прогноза и выработки тактики лечения больных исследованием является морфологическое, иммуногистохимическое и цитогенетическое исследования ткани костного мозга. Исследование костномозгового пунктата в этом отношении является несравненно более информативным, чем определение морфологического состава периферической крови.
Используются два способа получения материала: 1) аспирационная биопсия костного мозга и 2) трепанобиопсия из гребня подвздошной кости.
При цитологическом исследовании костного мозга (миелограмма) можно оценить наличие дисплазии миелоидного ростка.


- Межъядерные цитоплазматические мостики
- Кариорексис
- Многоядерность
- Баббл-формы
- Мегалобластоидность
- Кольцевидные сидеробласты
- Вакуолизация
- Положительная реакция с Шифф-йодной кислотой
Дисгранулопоэз
- Маленькие или чрезмерно большие клетки
- Гиполобулярность ядер (псевдо-Пельгер-Хюит аномалия)
- Неравномерная гиперсегментация
- Гипо-/агрануляция
- Гранулы псевдо Чедиак-Хагаси
- Палочки Ауэра
Дисмегакариопоэз
- Микромегакариоциты
- Гиполобулярные ядра
- Многоядерность
Гистологическое исследование костного мозга (трепанобиопсия) позволяет оценить архитектонику костного мозга, диффузный или очаговый характер изменений в нём, изучить соотношение кроветворной и жировой ткани, выявить атипичные клетки и т. п. Аспирация костного мозга при стернальной пункции так или иначе нарушает структуру костного мозга и не исключает примешивание к пунктату периферической крови. В связи с этим выполнение трепанобиопсии обязательно для подтверждения диагноза МДС.
Биохимические исследования обмена железа, содержания витамина В12 и фолиевой кислоты, иммунологические пробы призваны помочь провести дифференциальную диагностику с анемиями иного генеза, с учётом того, что у 80 % пациентов с МДС отмечается анемия.
МДС следует дифференцировать с другими онкогематологическими заболеваниями, включая острые и хронические лейкозы, а также лимфопролиферативные заболевания.
Часть изменений, свойственных МДС (в частности, моноцитоз, цитопенические нарушения), могут отмечаться при некоторых инфекционных процессах.
При отравлении тяжелыми металлами могут отмечаться изменения эритроцитарного ростка, сходные с таковыми при сидеробластных анемиях.
У пациентов с наследственными цитопениями рекомендуется проведение дополнительного генетического исследования, которое поможет выявить анемию Фанкони и врождённый дискератоз.
Цитогенетические нарушения [ править | править код ]

При диагностике хромосомные аномалии обнаруживаются у 40-70 % пациентов с первичным MDS и у 95 % пациентов, MDS которых связан с терапией (вторичный).
К наиболее часто встречающимся при MDS цитогенетическим аномалиям относятся del(5q), −7 и +8. [6]
| Группа риска | Кариотип (22 группы) | Средняя выживаемость (мес) | Время, к которому 25 % пациентов развили ОМЛ |
|---|---|---|---|
| Благоприятная | 5q-, 12p-, 20q-, +21, -Y, 11q-, t(11(q23)), норма; любые 2 аномалии, включающие 5q- | 51 | 71,9 |
| Промежуточная-1 | +1q, аномалии 3q21/q26, +8, t(7q), +19, −21, любая др. одиночная поломка; любые двойные аномалии, не затрагивающие хр. 5q и 7 | 29 | 16 |
| Промежуточная-2 | -X, −7 или 7q-, любые двойные аномалии с −7 or 7q-, комплекс из 3х аномалий | 15,6 | 6 |
| Неблагоприятная | Более 3х аномалий | 5,9 | 2,8 |
Минимальные диагностические критерии [ править | править код ]
Минимальные диагностические критерии МДС включают обязательные диагностические условия (цитир. По NCCN, 2009) [7] — стабильная цитопения не менее 6 месяцев, (за исключением случаев, когда цитопения сопровождается специфическим кариотипом или дисплазией двух ростков кроветворения — в этих случаях длительность стабильной цитопении должна составлять не менее 2 месяцев).
- исключение других заболеваний, которые могут стать причиной развития дисплазии или/и цитопении.
В дополнение к этим двум диагностическим условиям для установления диагноза МДС необходимо соответствие хотя бы одному из трёх основных критериев:
- дисплазия (≥ 10 % клеток одного или более из трёх основных ростков кроветворения в костном мозге).
- содержание бластов в костном мозге 5-19 %.
- специфический кариотип, например делеция (5q), делеция (20q), +8 или −7/делеция (7q).
Кроме того, для диагностики МДС используются дополнительные критерии, в том числе результаты проточной цитометрии, гистологического и иммуногистохимического исследования костного мозга, выявления молекулярных маркеров.
Морфологическое исследование биоптатов, полученных путём билатеральной трепанобиопсии, является полезным, помимо верификации диагноза самого МДС, с точки зрения дифференциальной диагностики с лимфопролиферативными и другими миелопролиферативными заболеваниями. [7]
Дифференциальная диагностика [ править | править код ]
Дифференциальная диагностика проводится с:
- А. Мегалобластными анемиями (заболевания, характеризующиеся изменениями морфологии клеток к.м. вследствие нарушения синтеза ДНК. Более 90 % — В-12 и фолиево-дефицитные анемии).
После начала терапии витамином В-12 или фолиевой кислотой в анализе крови выявляется ретикулярный криз на 5-7 сутки и повышение показателей красной крови, что нехарактерно для больных рефрактерной анемией. Изменения кариотипа клеток костного мозга не встречаются при мегалобластных анемиях.
Апластическая анемия может быть врождённой, приобретённой и идиопатической. Врождённая апластическая анемия — анемия Фанкони сочетается с другими генетическими аномалиями (кожная пигментация, гипоплазия почек, микроцефалия), приобретённая связана с действием химических и физических агентов, инфекциями, нарушениями обмена веществ.
Для АА нехарактерны изменение кариотипа, гиперклеточный костный мозг.
- В. Анемии при ХПН.
- В. Анемии при хроническом активном гепатите характерно выявление маркеров вирусных инфекций, гепатоспленомегалия, клиническая картина хр. гепатита, изменения биохимических показателей крови (метаболизма билирубина, функции печени).
ФАБ-классификация [ править | править код ]
Разработка этой системы классификации франко-американо-британской группой была начата в 1976 году и позже, в 1982 году, она приняла свой окончательный вид.
В основе классификации лежит ключевой для МДС синдром — рефрактерная, то есть устойчивая к лечению препаратами витамина В12 и фолиевой кислоты, анемия (РА). Четыре типа РА являются последовательными стадиями, с нарастанием тяжести МДС, что имеет своё отражение в прогнозе выживаемости. В этой связи появление в КМ бластов резко меняет прогноз выживаемости в худшую сторону.
| Тип МДС | Бластов в периферической крови | Бластов в КМ | Другие патологические изменения | Выживаемость (лет) |
|---|---|---|---|---|
| Рефрактерная анемия (РА) | меньше 1 % | меньше 15 % кольцевых сидеробластов | меньше 5 % | 4,2 |
| РА с кольцевыми сидеробластами | меньше 1 % | больше 15 % кольцевых сидеробластов | меньше 5 % | 6,9 |
| РА с избытком бластов (РАИБ) | меньше 5 % | 5-20 % | — | 1,5 |
| РАИБ в стадии трансформации | больше 5 % | 21-29 % | Возможно наличие палочек Ауэра в КМ | 0,6 |
| ХММЛ | меньше 5 % | меньше 20 % | Моноциты больше 1х109/л | 2,4 |
Французско-американско-британская классификация позволяет отнести пациента к той или иной группе миелодиспластических синдромов в зависимости от морфологических показателей. Группа миелодиспластических синдромов включает пять заболеваний: рефрактерную анемию, рефрактерную анемию с кольцевыми сидеробластами, рефрактерную анемию с избыточным количеством бластов, рефрактерную анемию с избыточным количеством бластов на стадии трансформации и хронический миеломоноцитарный лейкоз. Согласно французско-американско-британской номенклатуре пациентам, у которых содержание бластов в костном мозге превышает 30 %, устанавливается диагноз острого миелоидного лейкоза.
В данной классификации хронический миеломоноцитарный лейкоз относится к группе миелодиспластических синдромов, несмотря на то, что это заболевание часто характеризуется признаками миелопролиферативного расстройства. [8]
Классификация ВОЗ [ править | править код ]
В 2002 году Всемирная организация здравоохранения предложила новую классификацию миелодиспластических синдромов [9] [10] [11] в 2008 году были сделаны предложения по её пересмотру. [12] [13]
Подгруппы, выделяемые в классификации ВОЗ включают: рефрактерную анемию и рефрактерную анемию с кольцевыми сидеробластами, рефрактерную цитопению с множественной дисплазией, рефрактерную анемию с избыточным количеством бластов-1 (содержание бластов в костном мозге составляет менее 10 %), рефрактерную анемию с избыточным количеством бластов-2 (содержание бластов в костном мозге превышает 10 %), синдром делеции 5q и миелодиспластический синдром неклассифицированный (с наличием или отсутствием кольцевых сидеробластов).
Пациенты, ранее классифицировавшиеся как страдающие хроническим миеломоноцитарным лейкозом, относятся к группе миелодиспластических синдромов/миелопролиферативных заболеваний.
Синдром делеции 5q, выделяемый в классификации Всемирной организации здравоохранения в отдельную подгруппу, характеризуется изолированной делецией 5q [14] [15] [16] и содержанием бластов в костном мозге меньше 5 %, часто в сочетании с тромбоцитозом.
| Тип МДС | Изменения в крови | Изменения в КМ |
|---|---|---|
| Рефрактерная анемия (РА) | Анемия, меньше 1 % бластов | Дисплазия эритроидного ростка, меньше 5 % бластов |
| Рефрактерная анемия с кольцевыми сидеробластами (РАКС) | То же, что и РА | то же, что и РА, ≥ 15 % кольцевых сидеробластов |
| Рефрактерная цитопения с многоростковой дисплазией (РЦМД) | Цитопения по 2-3 росткам, меньше 1 % бластов | Дисплазия в больше 10 % клеток 2 или 3 ростков, меньше 5 % бластов, меньше 15 % кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС) | То же, что и РЦМД | То же, что и РЦМД, ≥ 15 % кольцевых сидеробластов |
| Рефрактерная анемия с избытком бластов, тип I (РАИБ-1) | Цитопении, меньше 5 % бластов | 5-9 % бластов |
| Рефрактерная анемия с избытком бластов, тип II (РАИБ-2) | Цитопении, 5-19 % бластов | 10-19 % бластов |
| Синдром 5q- | Анемия, нормальное или повышенное содержание тромбоцитов | Нормальное или увеличенное количество мегакариоцитов с гипосегментированными ядрами; изолированная делеция 5q31 |
| МДС неклассифицированный (МДС-Н) | Цитопения | Унилинейная дисплазия в нейтрофильном или мегакариоцитарном ростках, Бласты менее 5 %, Палочки Ауэра отсутствуют |
Всемирная организация здравоохранения предложила исключить рефрактерную анемию с избыточным количеством бластов на стадии трансформации из группы миелодиспластических синдромов (диагноз острого миелоидного лейкоза устанавливается, если содержание бластов в костном мозге превышает 20 %, тогда как ранее для установления этого диагноза содержание бластов должно было превышать 30 %). Однако миелодиспластические синдромы отличаются от вновь диагностированного острого миелоидного лейкоза не только содержанием бластов, но и течением заболевания, обусловленным определёнными биологическими свойствами. Кроме того, эти группы заболеваний обычно отличаются и по частоте терапевтических ответов.
Шкала IPSS [ править | править код ]
Шкала IPSS (International Scoring Prognostic System — Международная шкала оценки прогноза) была разработана в 1997 году с целью дать специалистам, помимо классификации, практический инструмент по оценке прогноза и выбора тактики лечения для пациентов с впервые установленным диагнозом МДС (то есть не подходит для прогноза уже леченных пациентов с МДС).
Вторичный МДС оценивается как изначально неблагоприятный, автоматически попадающий в категорию наиболее высокого риска согласно IPSS.
Тремя факторами, которые учитывает IPSS для оценки прогноза, являются количество бластов, категория цитогенетического риска и количество поражённых цитопенией линий.
Трактовка результатов суммирования баллов по этим трем параметрам представлена в таблице: [16]
 26-07-2019
26-07-2019 0 Просмотров
0 Просмотров 0 комментариев
0 комментариев 0 Рейтинг
0 Рейтинг